
목차
납산 배터리란?
납산배터리의 역사
납 축전지 (Lead-acid battery) 라고도 불리우는 납산 배터리는 단어 그대로 납과 황산을 이용한 이차전지 입니다. 주로 자동차의 배터리등에 사용되고 다른 이차 전지에 비해서 용량이나 전압이 큰 것이 특징입니다.
1859년 프랑스의 물리학자 가스통 플랑테 (Gaston Palnte) 에 의해 발명되었는데요, 당시 가스톤 플랑테의 최초의 충전용 전지는 전세계 전기시장에 혁명과도 같은 일이었습니다.
160년이 넘게 흐른 지금에도 모든 충전용 배터리는 이 기술을 기반으로 발전되었고, 현재의 전기자동차의 주력 배터리인 리튬이온전지가 등장한 이 시기에도 대부분의 차량에는 납산 배터리가 탑재되고 있습니다.
납은 원자번호 82번 원소로 원소기호는 Pb 입니다.
주기율표에서는 탄소와 규소등과 함께 14족 (4A)에 속하고 있습니다. 14족의 모든 원소는 할로겐이나 산소와의 화합물에서 +4인 산화상태를 유지하고 수소와 결합한 수소화물에서는 -4가의 산화 상태를 갖고 있습니다. 이 4개의 결합수가 균형을 이루면서 극성을 띄지 않는 특성이 있습니다. 납의 전자배치를 보게 되면 아래 그림과 같이 최외각 전자가 4개를 이루고 있는 것을 확인할 수 있습니다.

납산 배터리의 구조
양극으로 쓰이는 이산화 납판 과 음극으로 쓰이는 납판이 묽은 황산에 잠겨 있는 구조를 갖고 있습니다. 예전에 개발된 납 축전지는 밀폐상태가 좋지 않아 주기적으로 황산을 충전해 주어야 했지만 현재는 제조기술의 발전으로 내부가 완전히 밀폐되어 왠만한 충격이 있지 않고서는 황산 누출이 발생하는 일은 없다고 보시면 됩니다.
납산 배터리의 산화전극은 전해질과 최대한 접촉할 수 있도록 다공성 금속 순수납을 사용하게 되고, 환원전극은 비슷한 모양의 이산화 납으로 되어 있습니다. 그리고 이 두 금속이 전해질로 사용되는 황산 용액에 담겨져 있습니다.
배터리가 충전되고 방전되는 기본적인 원리는 물질의 산화와 환원반응입니다. 여기서 산화(Oxidation)라는 것은 전자를 잃는 현상을 말하며, 환원(Reduction)은 전자를 얻게 되는 현상을 뜻합니다.

일단 배터리가 완전히 충전된 상태를 살펴보겠습니다.
이때부터 방전이 발생할 수 있는데요, 현재 양극(+)은 이산화납 상태로 존재하고 음극(-)은 납으로 이루어져 있습니다.
두 전극이 담겨져 있는 전해액은 묽은 황산 (H2SO4) 이며 상온 20도에서 밀도는 약 1.280[g/cm^3] 입니다.
전해액은 밀도에 따라 항상 일정비의 수소 양이온과 황산 음이온으로 분리되어 있는데 이러한 이온의 분리 상태를 해리(dissociation) 이라고 표현합니다.
이제 방전되는 경우를 살펴보겠습니다.
음극판과 양극판을 전선으로 연결하고 스위치와 전구를 장착했다고 가정해 봅시다.
이제 전구를 켜기위해 스위치를 연결하게 되면 전류는 양극판에서 전선을 타고 음극판으로 흐르게 됩니다. 반면 전자는 전류와 반대로 움직이므로 음극판에서 양극판으로 이동합니다.
납산 배터리의 화학 반응 원리
1️⃣ 양극판을 이루는 과산화납 (PbO2)은 납의 4가 양이온 (Pb4+) 과 산소의 2가 음이온(O2-) 으로 분해됩니다.
2️⃣ 양극판으로부터 분리된 산소의 2가 음이온들이 전해액에서 해리된 상태에 있는 수소의 1가 양이온들과 반응하여
물을 생성합니다.

3️⃣ 동시에 음극을 통해 전자가 빠져나가 전구를 거쳐 양극으로 전자가 이동하게 되면 납의 4가 양이온으로 부터
2가의 납-양이온이 생성됩니다.
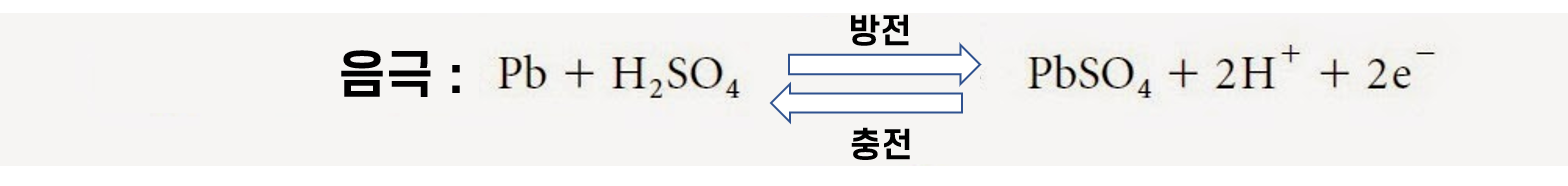
4️⃣ 이어서 2가의 납-양이온은 전해액에서 해리된 2가의 황산-음이온과 반응하여 황산납(PbSO4)이 됩니다.
이런 과정을 반복하면서 전자가 계속 이동하게 되고 한개의 전지에서 약 2볼트의 전압이 생성됩니다. 즉 12볼트를 내기 위해서 6개의 전지가 내부에 구성되어 있는 것이죠.


이들 여섯개의 2볼트 전지들은 잘 패킹되어 단단한 고무나 플라스틱 용기에 담겨져 있습니다.

우리가 늘 일상에서 사용하고 보아오던 자동차용 배터리에 이런 원리가 숨어있는 줄을 생각하지 못했던 것 같습니다. 기회가 되면 조금더 자세히 포스팅을 보충해 볼 까 합니다.